体温计是我司做得非常成熟的产品之一。本次申请过程非常顺利,从提交资料给FDA到批准用时3个多月。于2021年7月22日收到一次书面发补,发补共三点不符合项,其中一个不符合项为第三方测试报告中的测试数据出现手误,关于此不符合项,我司用较快的时间联系兴洲电子并要求其按照FDA要求进行重新检测,客户配合迅速,用时3个工作日即出了测试报告。另外一个为彩盒出现发烧提示字样,出现的这个错误主要原因是做彩盒资料时检查不到位,整改方案改为高温提示。第三个为清洁消、毒方法问题,审核员要求将清洁和消、毒合在一起同时对清洁消、毒用的工具也有特别要求(之前申请的510k,FDA是要求分开清洁和消、毒的)并且明确是单个病人还是多个病人使用,由于清洁和消、毒方法的更改会涉及到重新验证的问题,为了避免重新验证,我们非常谨慎小心的措辞修改清洁和消、毒方法,并有条理地解释了为何更改前和更改后不影响之前的验证。就这样,我们仅用4天时间(2021年7月27日)就完成了整改并提交FDA。FDA收到邮件后就单个病人和多个病人使用的问题有过一次沟通。之后FDA没有提出任何其他问题,直到9月4日我们收到FDA关于批准该体温计510(K)的文件。 本次510(K)的申请,得到了客户的充分认可。
-
-
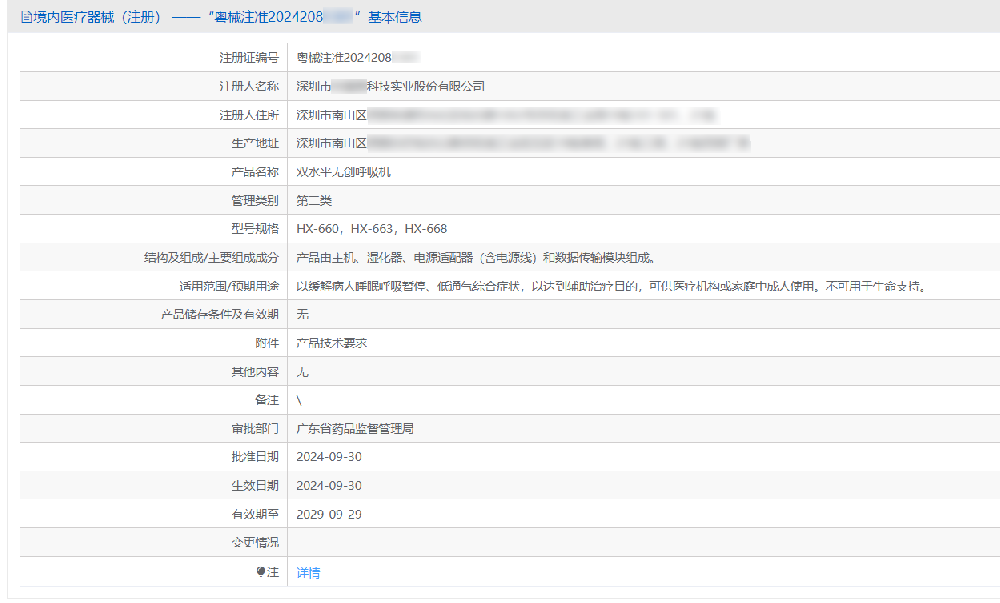
辅导深圳某企业获呼吸机NMPA注册证
2024-10-18


